文 | 1°C
近日,中国PD-(L)1单抗又有多个新的动态,较受关注的包括:1、恒瑞医药艾瑞卡 (卡瑞利珠单抗) 肝细胞癌二线治疗技术审评完成,进入行政审批阶段,或将成为首个在中国收获肝细胞癌的PD-(L)1单抗;2、2020年02月15日,泰圣奇 (阿替利珠单抗) 补充上市申请获承办,适应症肝细胞癌一线治疗;3、2020年02月21日, PD-1单抗赛帕利单抗递交上市申请,申请适应症复发或难治性经典霍奇金淋巴瘤;4、上海昀怡健康科技发展有限公司开发的重组抗PD-1全人源单克隆抗体注射液IND申请获承办 。
中国肝细胞癌进入肿瘤免疫时代:将先后迎来创新二线疗法和一线疗法
艾瑞卡 (卡瑞利珠单抗) 预计成为首个在中国收获肝细胞癌适应症PD-(L)1单抗
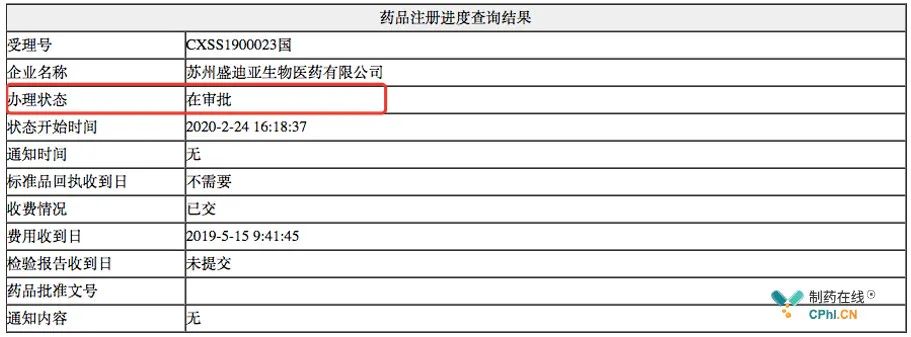
2020年02月24日,艾瑞卡受理号CXSS1900023更新办理状态,变更为"在审批",这意味着该受理号的技术审评已经结束。
NMPA
艾瑞卡 (卡瑞利珠单抗) 肝细胞癌二线治疗进入行政审批阶段后,意味着艾瑞卡预计成为首个在中国拓展肝细胞癌的PD-(L)1单抗,支持此次上市申请的关键临床试验是CTR20160871 (NCT02989922);
艾瑞卡可使肝细胞癌患者总体缓解率14.7%,6月总体生存率74.4%
- 登记号CTR20160871
- 220例入组患者,肝细胞癌一线治疗失败
- ORR, 32/217 (14·7%; 95% CI 10·3-20·2)
- 6月-总体生存率,74·4% (95% CI 68·0-79·7)]
泰圣奇 (阿替利珠单抗):阿替利珠单抗联合贝伐珠单抗肝细胞癌一线治疗方案
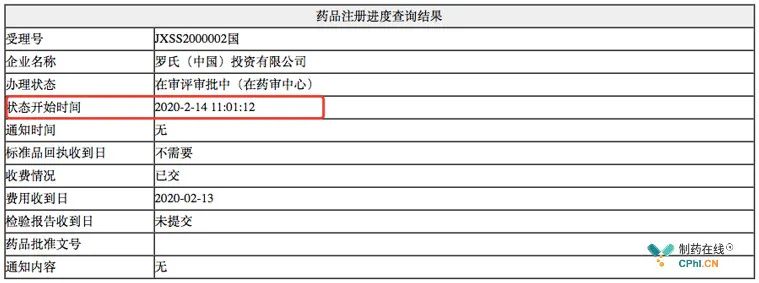
紧跟美国,仅在18天之后,2020年02月14日,罗氏向NMPA递交阿替利珠单抗第2个适应症上市申请,此次适应症为阿替利珠单抗联合贝伐珠单抗肝细胞癌一线治疗,此次上市申请的关键临床试验是IMbrave150,受理号JXSS2000002。
NMPA
IMbrave150中国:阿替利珠单抗联合贝伐珠单抗可使肝细胞癌患者死亡风险降低56%

Roche,https://www.roche.com/investors/updates/inv-update-2020-02-07.htm
赛帕利单抗同样选择霍奇金淋巴瘤做为首个申请上市适应症
2020年02月21日,药明生物与誉衡药业联合开发的PD-1单抗赛帕利单抗递交上市申请,申请适应症复发或难治性经典霍奇金淋巴瘤,受理号CXSS2000005,这是国内第9款申请上市的PD-(L)1单抗,也预计成为第4个获批用于霍奇金淋巴瘤的PD-(L)1单抗。
小编推荐:
中国医药子公司维格列汀片获得药
从信任危机到全球争锋 跌宕起伏
药极客荣获CFS第十届中国财经峰
先声药业与博鳌恒大国际医院合作
中国养生网()



 美业风向朝哪吹?或许这
美业风向朝哪吹?或许这