2月26 日,东阳光药业「盐酸芬戈莫德胶囊」上市申请获药审中心承办,治疗多发性硬化症(受理号:CYHS2000114)。

多发性硬化(Multiple sclerosis, MS)作为罕见病的一种,是严重、终身、进行性、致残性的中枢神经系统疾病,好发于青壮年。我国预计约有 3 万名多发性硬化患者,发病高峰年龄为 20-40 岁,即青壮年时期。在中国,该疾病被列入第一批罕见病目录。
根据《多发性硬化患者生存报告(2018)》,中国多发性硬化症(MS)的治疗现状与外国差距大,多发性硬化症尚无有效的根治疗法,临床上主要以疾病修正治疗 (Disease-modifying treatments ,DMT) 为主。报告显示,目前在我国能够得到修正治疗的患者只有 10%,欧美国家 86%,与外国治疗水平相差巨大。
国内目前可用的多发性硬化症药较少,有干扰素β-1a(商品名:Rebif)、特立氟胺以和芬戈莫德。
芬戈莫德,是一种 1-磷酸鞘氨醇受体调节剂,原研是诺华(商品名:Gilenya),在 2010 年 9 月 21 日获 FDA 批准上市,用于治疗复发型多发性硬化症(MS)患者。诺华 2019 年财报显示,芬戈莫德全球销售额达到 32.23 亿美元,同比去年略有下降(2018 年:33.41 亿美元)。
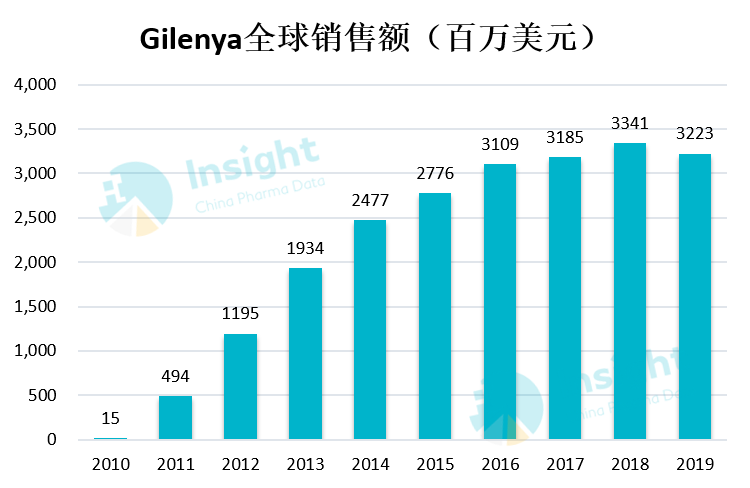
在国内,诺华芬戈莫德胶囊在 2018 年被列入第一批临床急需境外新药新药名单,2019 年 4 月国内提交上市申请,在 2019 年 7 月 12 日获批进口,用于治疗 10 岁或 10 岁以上患者的复发型多发性硬化 (RMS),中文商品名:捷灵亚。
2020 年 1 月 6 日,诺华官微宣布,捷灵亚在中国开出首张处方,截至目前该药已在全球 80 多个国家获批,使近 30 万患者获益。据网络流传,该药在国内的价格为 10500 元/28 粒(14 粒/板),不包括赠药。
芬戈莫德在美国化合物专利 2019 年 2 月 18 日到期,在 2019 年 12 月,东阳光药业盐酸芬戈莫德胶囊获得美国首仿上市。
Insight 数据库显示,国内芬戈莫德在研的企业共有 6 家,均已获批临床;其中胶囊剂有 4 家企业在研,分别是南京华威(成都百裕制药的盐酸芬戈莫德胶囊转让给华威医药)、豪森、山东创新药物研发公司、中国人民解放军军事医学科学院毒物药物研究所。
东阳光药业盐酸芬戈莫德胶囊有望凭借中美共线生产、已在 FDA 批准上市纳入优先审评,从而加速在国内获批的速度,为国内多发性硬化症患者带来更多用药选择。
原标题:32 亿美元重磅品种,东阳光药业「盐酸芬戈莫德胶囊」国内首仿报上市
*声明:本文由入驻新浪医药新闻作者撰写,观点仅代表作者本人,不代表新浪医药新闻立场。


 美业风向朝哪吹?或许这
美业风向朝哪吹?或许这