阿尔茨海默病是一种影响广泛的神经退行性疾病,其标志性的病理特征是β-淀粉样蛋白的沉积与神经原纤维的缠结。过去,许多科学家们认为β-淀粉样蛋白沉积与阿尔茨海默病的发病有关,也设计了不少靶向β-淀粉样蛋白的药物。然而至今,我们仍很少看见完全令人信服的疗效。

今日,发表在《自然》子刊Nature Communications上的一项研究,向我们揭晓了一个有趣的发现:在实验室中用以研究的β-淀粉样蛋白,在结构上与患者大脑里的β-淀粉样蛋白有着很明显的不同。这或许能够解释,为何实验室中的一些灵丹妙药,在患者体内却会失效。
这项研究由德国乌尔姆大学(Ulm University)的科学家们主导。在研究里,他们从三名阿尔茨海默病患者遗体的大脑组织里纯化出了β-淀粉样蛋白的原纤维,并使用冷冻电镜技术对其进行结构分析。分析结果表明,这三名患者的β-淀粉样蛋白原纤维形态虽然各不相同,但在结构上有很高的相关性。
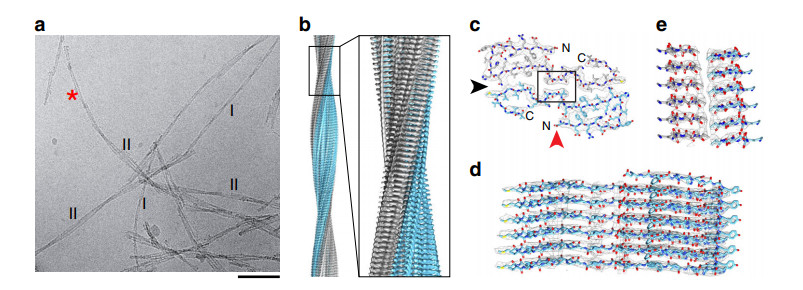
▲冷冻电镜下所观察到的结构(图片来源:参考资料[1])
有意思的是,与通过化学合成或是重组表达产生的β-淀粉样蛋白原纤维相比,患者大脑里的致病蛋白结构有着显著的结构差异。譬如,体外获取的样本,往往是左旋结构(left-hand twisted)。而大脑中的蛋白,则是右旋结构(right-hand twisted)。此外,与先前的分析结果相比,它们的肽折叠方式也有明显的不同。
在论文的讨论环节,作者们表示他们所发现的右旋结构“非常有趣”,这强调了研究真实患者大脑样本的重要性。不过,作者们也谨慎地表示,虽然观察到了不同,但不代表体外合成的β-淀粉样蛋白原纤维就一定与疾病无关。他们保守地指出,这些发现表明我们在体外合成β-淀粉样蛋白原纤维所使用的条件,可能与体内的真实情况有些不同,导致了结构上的差异。这些差异的具体影响,还需要进一步的探索。
《自然》提供的新闻简介指出,“该研究还有助于理解阿尔茨海默病导致的突变对β淀粉样蛋白的影响,或有助于开发防止这类原纤维形成的药物。”
参考资料:[1] Kollmer, M., Close, W., Funk, L. et al. Cryo-EM structure and polymorphism of Aβ amyloid fibrils purified from Alzheimer’s brain tissue. Nat Commun 10, 4760 (2019) doi:10.1038/s41467-019-12683-8



 美业风向朝哪吹?或许这
美业风向朝哪吹?或许这